末梢神経損傷に対する同種臍帯由来間葉系細胞を用いた三次元神経導管移植治療の医師主導治験の開始
株式会社サイフューズ
(概略)
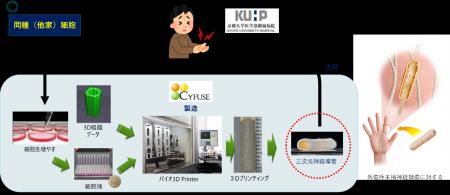
京都大学医学部附属病院整形外科(松田秀一教授)、同リハビリテーション科(池口良輔教授)は、東京大学医科学研究所附属病院臍帯血・臍帯バンク/セルプロセッシング・輸血部(長村登紀子准教授)、株式会社サイフューズ(秋枝静香代表取締役)と共に、末梢神経損傷に対する新しい治療法として、臍帯由来間葉系細胞を原材料としてバイオ3Dプリンタを用いて製造した三次元神経導管の同種移植を行う世界で初めての治療方法の開発に成功しました。そしてこの度、京都大学医学部附属病院先端医療研究開発機構(iACT)と共に、手指の末梢神経損傷患者さんに対する医師主導治験を2026年1月から開始します。
1.背景
従来の末梢神経損傷に対する治療は、自己の健常な神経を犠牲にする自家神経移植が主流です。自家神経を犠牲にする治療を回避する目的で人工神経の開発が行われていますが、自家神経移植術を超える成績は得られていないため、一般には普及していないのが現状です。これまでに京都大学医学部附属病院整形外科では、患者さん自身の皮膚の一部から細胞を培養し、バイオ3Dプリンタを用いて自家細胞のみで製造したヒト(自己)三次元神経導管を、手指の末梢神経を損傷した患者さんに移植する医師主導治験を実施し、良好な結果を得てきました。
しかしながら、自家細胞を用いる場合には、患者さんの体の一部から組織を採取するため、わずかではありますが侵襲性があること、かつ三次元神経導管を製造するまで一定期間、手術を待機しなければならないという課題がありました。この課題を解決するため、東京大学医科学研究所附属病院臍帯血・臍帯バンク/セルプロセッシング・輸血部で開発された臍帯由来の間葉系細胞を原材料とするヒト(同種)三次元神経導管の製造を計画しました。臍帯から得られる間葉系細胞には、免疫調整能や組織修復能があり、同研究所の長村登紀子准教授は、臍帯由来の間葉系細胞を難病治療に利用するための研究を進めています。
2.研究手法・成果
同種移植を行う際には患者さん自身の細胞を用いないため、拒絶反応が起こります。通常の同種移植においては免疫反応を抑制する免疫抑制剤を用いることで、拒絶反応は起こらないようにします。ラットを用いた先行研究において、東京大学医科学研究所附属病院臍帯血・臍帯バンク/セルプロセッシング・輸血部で開発された間葉系細胞を三次元神経導管の製造に用いることで、免疫抑制剤なしでも拒絶反応を起こさず、良好な神経が再生することが確認されています(論文1)。
これらの研究は国立研究開発法人日本医療研究開発機構(AMED)令和4年度 再生医療等実用化研究事業「末梢神経損傷に対する同種臍帯由来間葉系細胞を用いた三次元神経導管移植治療法の開発」の助成を得て、非臨床有効性、非臨床安全性試験(論文2)を実施し、京都大学医学部附属病院の医薬品等臨床研究審査委員会(治験審査委員会)の承認を得て、医薬品医療機器総合機構(PMDA)に治験計画届を提出しました。
今回の医師主導治験においては、株式会社サイフューズの開発した臨床用バイオ3Dプリンタを、東京大学医科学研究所附属病院細胞リソースセンター内の細胞調製室に設置し、治験製品の製造を行います。
[画像:
https://prcdn.freetls.fastly.net/release_image/46287/52/46287-52-a8b876f1ef6b0cd5f0a794f1a32b7c29-1472x638.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
3.今後の予定
京都大学医学部附属病院整形外科は、手指の外傷性末梢神経損傷に対して、臍帯由来間葉系細胞を原材料として臨床用バイオ3Dプリンタを用いて製造した三次元神経導管移植の医師主導治験を実施します。これまでに同種の細胞から調製した三次元組織を、免疫抑制剤を使用せず移植する治療は報告されていません。本治験が成功した際には、世界初の同種の細胞から調製した三次元組織を移植する再生治療となり、再生医療の開発が加速することが期待されます。
また、将来的には患者さんご自身の細胞(自家細胞)を用いた治療または同種細胞を用いた治療、いずれかを選択できるような体制が構築されることで、治療法の選択肢を広げていくことを目指して参ります。
【治験の方法】
治験の同意取得後、東京大学医科学研究所附属病院臍帯血・臍帯バンク/セルプロセッシング・輸血部で、臍帯由来間葉系細胞を用いた三次元神経導管を製造し、京都大学医学部附属病院に搬送して、患者さんの神経損傷部に移植します。治験製品の移植後、36週間の観察期間で安全性と有効性を確認します。
【対象疾患】
外傷性末梢神経損傷
・外傷等による末梢神経断裂・欠損部位が手関節遠位にある方
・受傷日より6か月以内に登録が可能である方
・人工神経移植、および自家神経移植を希望しない方
・同意取得時の年齢が18歳以上の男女
【治験実施体制】
主任研究者:松田秀一(京都大学医学部附属病院 整形外科 教授)
自ら治験を実施する者/治験責任医師:池口良輔(京都大学医学附属病院 リハビリテーション科 教授)
治験製品製造責任者:青山朋樹(京都大学大学院 医学研究科 人間健康科学系専攻 教授)
治験製品製造施設管理者:長村登紀子(東京大学医科学研究所附属病院 臍帯血・臍帯バンク施設長/セルプロセッシング・輸血部 准教授)
治験製品製造協力者:秋枝静香(株式会社サイフューズ 代表取締役)
4.研究プロジェクトについて
本治験は、国立研究開発法人日本医療研究開発機構(AMED)令和7年度 再生医療等実用化研究事業「末梢神経損傷に対する同種臍帯由来間葉系細胞を用いた三次元神経導管移植の医師主導治験に関する研究開発」の支援を受けて実施します。
<論文タイトルと著者>
論文1
タイトル:Nerve regeneration using a Bio 3D conduit derived from umbilical cord-Derived mesenchymal stem cells in a rat sciatic nerve defect model.
著者:Iwai T, Ikeguchi R, Aoyama T, Noguchi T, Yoshimoto K, Sakamoto D, Fujita K, Miyazaki Y, Akieda S, Nagamura-Inoue T, Nagamura F, Nakayama K, Matsuda S.
掲載誌:PLoS One. 2024 Dec 23;19(12):e0310711. doi: 10.1371/journal.pone.0310711.
論文2
タイトル: Efficacy and safety of Bio 3D conduits composed of human umbilical cord-derived mesenchymal stromal cells: A proof-of-concept study in a canine ulnar nerve defect model.
著者:Fujita K, Ikeguchi R, Aoyama T, Noguchi T, Yoshimoto K, Sakamoto D, Iwai T, Miyamoto T, Miyazaki Y, Akieda S, Nagamura-Inoue T, Nagamura F, Nakayama K, Matsuda S.
掲載誌:Cell Transplant.2025 Jan-Dec;34:9636897251361711. doi:10.1177/09636897251361711.
【サイフューズ社概要】
株式会社サイフューズは、佐賀大学中山功一教授の発明をもとに、細胞のみから立体的な組織・臓器を作製するという独自の基盤技術を活用し、病気やケガで機能不全になった組織・臓器等を再生させ、従来の手術や治療法では満たされることのなかったアンメットニーズに応え、多くの患者さんに貢献することを目指し2010年に設立された、再生医療ベンチャーです。
株式会社サイフューズは、現在、独自の基盤技術を用いて、人工の足場材料(スキャフォールド)を使用せずに、立体的な組織・臓器を製造し、再生医療分野における骨軟骨や血管、末梢神経などを再生する画期的な再生医療等製品の実用化及び病気のメカニズムを解明する病態モデルや新薬の有効性・毒性・代謝等を評価する創薬スクリーニングツールとしての細胞製品の実用化を進めております。
なお、本件が2025年12月期の通期業績に与える影響は軽微でありますが、今後の当社の企業価値向上に大きく資するものであることから、今後公表すべき事項が生じた場合には、速やかに公表いたします。
<取材に関するお問い合わせ先>
株式会社サイフューズ 経営管理部
E-mail:ir@cyfusebm.com
プレスリリース提供:PR TIMES
記事提供:PRTimes
![]()